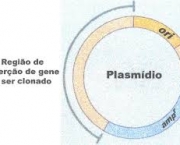
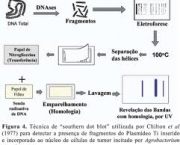
As substâncias em maior abundância são os sais, sendo em grande parte o resultado da reação entre ácidos e bases. Os sais mais populares são o cloreto de sódio, o nitrato de sódio, o sulfato de cálcio e o carbonato de cálcio. Os sais são uma composição formada por iônicos, sendo, desse modo, eletrólitos. Eles são constituídos por uma reação química ocorrida entre um ácido e uma base. Durante essa reação, chamada de reação de salificação, ou também de neutralização, água é formada juntamente com o sal. Resumindo em uma fórmula: a soma de ácido com base resulta em sal e água.
Com isso, por exemplo, o sal de maior fama, chamado de cloreto de sódio, muito utilizado na cozinha, é formado por uma reação a qual se dá entre o ácido clorídrico como o hidróxido de sódio. A fórmula dessa reação está logo abaixo:
HCI + NaOH ⇒ NaCI + H2O
Numa solução aquosa, os sais, sem exceção, fornecem no mínimo um cátion diferente do H+ ou um ânion do OH-. Sendo assim, o cloreto de sódio, ainda como exemplo, fornece o cátion Na+ e o ânion CI-.
Um sal é, portanto, um eletrólito iônico que se forma em decorrência de uma reação química entre um ácido e uma base.
Quais São As Principais Propriedades Funcionais Dos Sais?
- Normalmente têm sabor salgado.
- Os sais têm a capacidade de conduzir corrente elétrica, quando se encontram em solução aquosa.
- Eles também têm a capacidade de reagir com ácidos, com bases, com diferentes sais e ainda com metais.
As Mais Possíveis Reações Com Sais:
- Quando o sal reage com um ácido, a reação resulta em um outro sal e em outro ácido.
- Se o sal reage com uma base o final dessa reação é a formação de um novo sal e de uma nova base.
- A reação de um sal com um outro sal, causa a formação de dois diferentes sais, através de uma reação denominada como dupla troca.
- Se o sal reage com um metal o resultado é um outro sal e um outro metal, por meio de uma reação denominada como simples troca.
Quais São Os Tipos De Sais Que Existem?
Os sais se dividem entre os sais normais, os sais básicos e os sais duplos. Os sais normais se dividem entre sais oxigenados e sais não oxigenados. Os sais oxigenados são aqueles os quais derivam dos oxiácidos. Já os sais não oxigenados são aqueles que derivam dos hidrácidos.
Entenda Melhor Sobre o Cloreto De Sódio – De Sigla NaCl:
- Nos alimentos o cloreto de sódio é um composto obrigatório por decreto de lei, somado a adição de determinada quantia de iodeto no sal de cozinha, tendo a finalidade de prevenir a doença do bócio.
- Essa substancia serve também para a conservação da carne, de alguns peixes e, também, para a conservação de peles.
- Age na formação de misturas refrigerantes acontecendo pela mistura do gelo com o cloreto de sódio, chegando a alcançar menos vinte e dois graus Celsius.
- Formação de Na, Cl2, H2, e outros compostos sejam eles de sódio como de cloro.
- No estudo da medicina o cloreto de sódio é utilizado sob a forma de soro fisiológico, a qual é uma solução aquosa que contém menos de um por cento dessa substancia, atuando na prevenção da desidratação.
- Esse tipo de sal é muito utilizado em alimentos industrializados a fim de aumentar o prazo de validade de determinados alimentos. Somado a isso, o cloreto de sódio é uma substância presente no soro caseiro, o qual também é utilizado no combate à desidratação.
- No sal de cozinha, assim como o cloreto de sódio, há a presença de uma pequena quantia de iodeto de sódio e também de potássio. Essa medida protege o organismo de desenvolver o bócio por exemplo, doença a qual geralmente se desenvolve quando uma pessoa têm uma alimentação com baixa quantidade de sais de iodo.
Conheça Mais Sobre o Nitrato De Sódio – De Sigla NaNO3:
- Esse é um fertilizante muito popular na agricultura.
- É muito usado na fabricação da pólvora.
- O nitrato de sódio é popularmente conhecido pelo termo Salitre do Chile, sendo que esse mesmo sal é um tipo de fertilizante nitrogenado dos mais populares.
Saiba Mais Sobre o Carbonato De Sódio – Resumido Pela Sigla Na2CO3:
- O produto pronto para ser comercializado se encontra pelo nome de Soda.
- A fabricação do vidro comum é onde se faz o maior uso do carbonato de sódio.
- É também usado para a fabricação de sabões.
As Principais Características Do Bicarbonato De Sódio – De Sigla NaHCO3:
- É um antiácido estomacal.
- Muito utilizado na produção de digestivos, como os famosos sais de frutas.
- Fabricação de fermento químico. O crescimento da massa (bolos, bolachas, etc) é devido à liberação do CO2 do NaHCO3.
- Outro uso muito comum do bicarbonato de sódio é na fabricação de extintores de incêndio, aqueles extintores os quais soltam uma espuma quando utilizados. Ha países em que esse tipo de extintor separa os componentes em compartimentos distintos para, quando acionado, misturar os componentes e então resultar na formação dessa espuma a qual serve para apagar o fogo. Esse tipo de extintor jamais deve ser utilizado para acabar com o fogo em instalações elétricas, pois essa espuma é eletrolítica, ou seja, ela tem o poder de conduzir corrente elétrica.
- Outro uso muito comum do bicarbonato de sódio é em remédios os quais agem como antiácidos estomacais.
- É um componente que serve ainda como um fermento na produção de pães e de receitas similares, sendo que solta gás carbônico aquecido para o meio. Esse mesmo gás carbônico provoca o crescimento de massas desse tipo.